Établir un tableau d'avancement
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Savoir établir un tableau d’avancement.
- Effectuer les calculs relatifs à l’état initial et final pour déterminer la composition du mélange initial et final.
- Le tableau d’avancement d’une transformation chimique s’écrit à partir de l’équation de la réaction et des quantités de matière initiales des espèces chimiques.
- La composition du système dans
l’état intermédiaire s’exprime en
fonction de sa composition initiale et de
l’avancement maximal
 .
.
- L’avancement maximal d’une réaction se détermine à partir du réactif limitant.
- La composition de l’état final d’un système se détermine à partir de l’avancement maximal et des conditions initiales.
- Réactifs et produits
- Équilibrer une équation chimique
- Quantité de matière, masse, masse
molaire, concentration massique et molaire pour pouvoir
calculer

Le système est décrit par une réaction chimique. Il va évoluer en passant par plusieurs stades appelés « états ».
- À l’état initial, on met en contact les réactifs.
- À l’état intermédiaire, les réactifs se transforment progressivement en produits. Le système chimique contient à la fois les réactifs et les produits.
- À l’état final, la réaction n’évolue plus.
L’évolution d’un système chimique nécessite donc de connaitre au préalable les quantités de matière des réactifs mis en jeu, ainsi que les quantités de matière des produits formés.
Si un des réactifs est apporté en excès, il en restera dans l’état final. Si à l’inverse un des réactifs est en défaut, il sera totalement consommé et ne sera plus présent à l’état final.
Pour décrire l’évolution du système, on utilise un outil : le tableau d’avancement du système.
Ce tableau sert à déterminer le réactif limitant et à prévoir l’état du système en fin de réaction. L’état intermédiaire va dépendre de ce qu’on appelle « l’avancement de la réaction ».
Le tableau d’avancement s’établit en plusieurs étapes. La méthode suivante est appliquée dans le cas général.
-
Remplir la première ligne du tableau
— écrire l’équation de la
réaction.
On écrit l’équation de la réaction en tenant compte des réactifs introduits et des produits formés, ainsi que de leur état (solide, liquide, gaz, etc.).
On l’équilibre cette équation à l’aide des coefficients stœchiométriques (nombres que l’on positionne devant chaque élément chimique afin d’équilibrer la réaction).
On fait en général réagir 2 réactifs A et B, pour obtenir 2 produits C et D.
L’équation associée s’écrit aA + bB → cC + dD.
Remarque : a, b, c et d sont respectivement les coefficients stœchiométriques des espèces chimiques A, B, C et D.
Tableau d’avancement du système – Étape 1 -
Remplir les lignes et colonnes suivantes du
tableau.
On remplit le tableau d’avancement avec les lignes suivantes :
- Deuxième ligne : état du système ;
- Troisième ligne : état initial ;
- Quatrième ligne : état intermédiaire ;
- Cinquième ligne : état final.
On attribue une colonne pour l’avancement de la réaction
 , puis une colonne par
élément chimique A, B, C et D.
, puis une colonne par
élément chimique A, B, C et D.

Tableau d’avancement du système – Étape 2 -
Calculer les quantités de matière
à l’état initial.
On calcule les quantités de matière initiales des réactifs à l’aide de l’énoncé.
À l’état initial, l’avancement est nul ( = 0) et la
quantité de matière des produits est
nulle puisqu’ils ne se sont pas encore
formés.
= 0) et la
quantité de matière des produits est
nulle puisqu’ils ne se sont pas encore
formés.
- Quantité de matière des
réactifs à l’état
initial :
 (A),
(A),  (B) ;
(B) ;
- Quantité de matière des produits
à l’état initial :
 (C) = 0 mol et
(C) = 0 mol et  (D) = 0 mol.
(D) = 0 mol.

Tableau d’avancement du système – Étape 3 - Quantité de matière des
réactifs à l’état
initial :
-
Exprimer les quantités de matière
à l’état
intermédiaire.
Au cours de la réaction, les quantités de réactifs diminuent alors que les quantités de produits augmentent.
Les quantités de matière des éléments qui disparaissent ou qui apparaissent sont directement reliées aux nombres stœchiométriques de ces éléments.
À l’état intermédiaire, pour un avancement
 , les quantités
de matière sont les suivantes.
, les quantités
de matière sont les suivantes.
- Quantité de matière du
réactif A à l’état
intermédiaire :
 .
.
C’est la quantité de matière initiale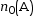 , à laquelle
on retranche ce qui a réagi au cours de la
réaction : si la réaction a
avancé de
, à laquelle
on retranche ce qui a réagi au cours de la
réaction : si la réaction a
avancé de  mole(s), alors
la quantité de matière de
l’élément A qui a
disparu est
mole(s), alors
la quantité de matière de
l’élément A qui a
disparu est  , avec a le
coefficient stœchiométrique
de A.
, avec a le
coefficient stœchiométrique
de A.
- Quantité de matière du
réactif B à l’état
intermédiaire :
 .
.
- Quantité de matière du
produit C à l’état
intermédiaire :
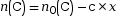 .
.
C’est la quantité de matière initiale , à laquelle
on additionne ce qui s’est formé au
cours de la réaction : si la
réaction a avancé
de
, à laquelle
on additionne ce qui s’est formé au
cours de la réaction : si la
réaction a avancé
de  mole(s), alors
la quantité de matière de
l’élément C qui
s’est formé est
mole(s), alors
la quantité de matière de
l’élément C qui
s’est formé est  , avec c le
coefficient stœchiométrique
de C. On a donc
, avec c le
coefficient stœchiométrique
de C. On a donc  .
.
- Quantité de matière du
produit D à l’état
intermédiaire :
 .
.

Tableau d’avancement du système – Étape 4 - Quantité de matière du
réactif A à l’état
intermédiaire :
-
Exprimer les quantités de matière
à l’état final.
À l’état final, l’avancement
 est maximal et
vaut
est maximal et
vaut  . On remplace
l’avancement
. On remplace
l’avancement  par
par  dans les
quantités de matière de
l’état intermédiaire.
dans les
quantités de matière de
l’état intermédiaire.
On obtient le tableau d’avancement suivant.
Tableau d’avancement du système
La réaction chimique s’arrête
lorsqu’un des deux réactifs a disparu.
Le réactif qui est totalement consommé en
premier est appelé le réactif
limitant.
Lorsque la quantité de matière du
réactif limitant est nulle, on a
l’avancement maximal.
Pour déterminer l’avancement maximal, on fait des hypothèses.
Hypothèse 1 : A est le réactif limitant,
donc ![]() , soit
, soit ![]() .
.
Hypothèse 2 : B est le réactif limitant,
donc ![]() , soit
, soit ![]() .
.
On choisit la plus petite valeur de ![]() car la réaction
s’arrête dès que l’un des
réactifs est totalement consommé
(quantité de matière nulle).
car la réaction
s’arrête dès que l’un des
réactifs est totalement consommé
(quantité de matière nulle).
Lorsque les deux réactifs ont été totalement consommés à l’état final, on dit que les réactifs étaient introduits dans les proportions stœchiométriques.
La relation qui correspond s’écrit dans notre cas général :
On en déduit le réactif limitant et
l’avancement maximal ![]() . Cette valeur permet de
calculer les quantités de matière des
réactifs et des produits à
l’état final (dernière ligne du
tableau), en remplaçant
. Cette valeur permet de
calculer les quantités de matière des
réactifs et des produits à
l’état final (dernière ligne du
tableau), en remplaçant ![]() par sa valeur.
par sa valeur.
On étudie la réaction entre 1 mol d’ions iodure
L’équation équilibrée s’écrit

Hypothèse 1 : l’ion peroxodisulfate est le réactif limitant, donc 3 –
Hypothèse 2 : l’ion iodure est le réactif limitant, donc 1 – 2
On en déduit l’avancement maximal
On en déduit l'état final des éléments chimiques de cette réaction.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








